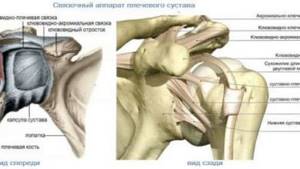
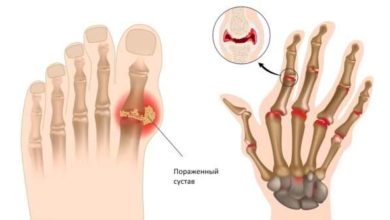
Абатацепт при псориатическом артрите был признан эффективным
Улучшение наблюдалось в подгруппах больных с более высоким исходным уровнем С-реактивного протеина, а также у анти-ФНО-наивных пациентов (не получавших терапию ингибиторами фактора некроза опухоли).
Данное исследование включало 424 участника с псориатическим артритом, которые были рандомизированы в 2 группы: 213 пациентов в течение 24 недель получали еженедельные инъекции абатацепта по 125 мг, остальные 211 получали плацебо.
Через 24 недели всем участникам абатацепт начали давать открыто; досрочный переход на open-label через 16 недель предусматривался для участников, у которых наблюдалось 20% улучшение по критериям Американского колледжа ревматологии (ACR20).
Авторы выполнили оценку скорректированных средних изменений к 16 и 24 неделе, учитывая факт назначение ингибиторов ФНО в прошлом и уровень С-реактивного протеина. Также был проведен анализ сообщенных пациентами изменений, соответствующих либо превышающих минимальные клинически значимые различия и нормативные значения.
В общей сложности 35,7% пациентов на абатацепте и 42,2% участников на плацебо досрочно переходили на прием абатацепта open-label. Препарат оказался эффективнее плацебо: сообщаемые пациентами исходы через 16 недель и далее были выше минимального клинически значимого различия и нормативных значений.
Лучшие результаты отмечены у терапевтически наивных участников, не получавших ингибиторы ФНО, а также при высоком уровне CRP на начало исследования.
Результаты сравнивали по краткой форме оценки здоровья SF-36 и стандартному индексу функциональной оценки результатов терапии хронического заболевания (FACIT).
Среди ограничений исследования отмечают ретроспективное сравнение результатов, а также большое количество участников, переведенных на абатацепт после 16 недели open-label – это могло повлиять на точность дальнейшего исследования.
Некоторые отмеченные пациентами эффекты со временем уменьшились – это, возможно, недостаточно учитывалось авторами.
В целом, абатацепт при псориатическом артрите был признан эффективным.
Проект финансировался фармацевтической компании Bristol-Myers Squibb – производителем препарата Оренсия. Некоторые авторы раскрыли свои связи с фармацевтической индустрией.